在癌症治疗领域,诱导邻近已成为一种新兴的治疗模式(如PROTACs、CAR-T、双特性T细胞衔接器BiTE等),通过特异性结合,改变靶标命运,诱导蛋白降解或细胞死亡。然而,由于大多数靶抗原在非肿瘤组织上也有表达,由此产生的“on-target off-tumour (OTOT)”毒性已成为邻近介导疗法临床发展的主要障碍之一。PROTACs技术因其催化特性可能导致治疗窗口狭窄,全身性给药时可能因“on-target”效应引起严重毒性。同样,部分免疫治疗患者则出现细胞因子风暴甚至致命的心肺毒性,这是免疫效应反应过度的结果。为克服这些难题,亟需实现肿瘤局部、按需激活的药物递送与免疫调节新策略。生物正交化学作为一种特异性高、反应温和的分子工具,已被应用于体内标记、药物递送等领域,但如何实现其在肿瘤中的靶向组装与精准激活尚未解决。
近期,太阳成集团tyc122ccvip应用化学系刘志博教授团队在Nature Biomedical Engineering上发表了题为Tumour-specific bioorthogonal synthesis of proteolysis-targeting chimeras and nanoparticles boosts T cell activity的研究文章。研究开发了一种以苯丙氨酸类似物Phe-BF3为激活剂的“脱保护-偶联(decaging-to-ligation, D2L)”平台,既可通过在细胞内原位组装PROTACs以招募E3连接酶降解靶蛋白,也可在肿瘤局部组装T细胞“纳米胶”从而精准募集并激活T细胞、增强抗肿瘤效果,并显著降低系统性毒副作用,为精准肿瘤治疗提供了全新策略和分子工具。
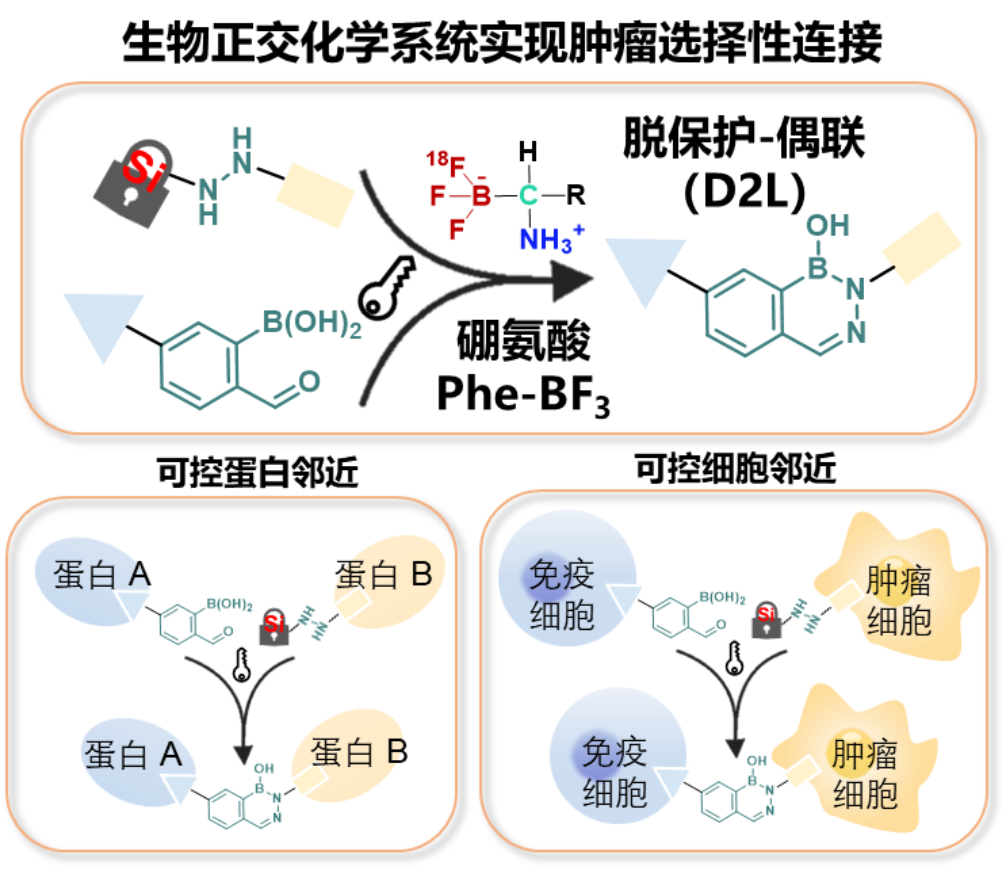
图1. 可控D2L生物正交组装平台的构建及其在邻近疗法药物中的应用
太阳成集团tyc122ccvip刘志博教授为论文通讯作者。刘志博团队特聘副研究员王春洪博士为论文第一作者。该工作得到了太阳成集团tyc122ccvip、北大-清华生命科学联合中心、昌平实验室、北京分子科学国家研究中心、中华人民共和国科学技术部、国家自然科学基金、北京市自然科学基金、中国博士后面上项目等机构和项目的资助。
论文链接:https://doi.org/10.1038/s41551-025-01560-z
![]()