邻近标记(proximity labeling)是近年来广泛应用于研究空间组学和生物大分子相互作用的化学工具1, 2。TurboID和APEX2等邻近标记酶能够在活细胞原位生成具有短寿命的活性中间体,从而在纳米尺度上实现对邻近区域内蛋白质或核酸的共价修饰和鉴定3-5(图1)。尽管该技术在生命科学领域已得到广泛使用,然而其核心技术参数——即邻近标记的作用半径究竟是多大,却长期未能在实验中被定量测定。这一局限不仅影响研究者对实验数据的解读,也限制着这些工具的进一步优化和应用。

2025年12月24日,122cc太阳成集团未来技术学院陈知行课题组和太阳成集团tyc122ccvip邹鹏课题组合作在Nature Chemical Biology杂志发表了题为Spatial barcoding reveals reaction radii and contact-dependent mechanism of proximity labeling的研究文章。研究团队构建了一种基于DNA 纳米结构(DNA nanostructures)的空间编码纳米尺平台(图1),以实现对微环境中的生化反应以纳米精度的空间分辨进行定量测量。该平台具有以下关键特性:
1.纳米尺度距离可控:通过可程序化设计的DNA纳米结构,精准调节标记靶标与邻近标记酶之间的距离,覆盖范围达到几十纳米,距离调节步长为1纳米。
2.核酸编码空间信息:每个位置的标记靶标对应一段特有的寡核苷酸序列,可实现在定量PCR分析中利用特异性引物精准区分不同距离靶标的标记水平。
3.高灵敏度定量检测:反应产物经富集后,利用定量PCR测定各标记靶标的相对丰度,绘制出“标记效率-空间距离”关系曲线。该方法首次实现了在严格受控的空间框架内对邻近标记进行定量化研究。
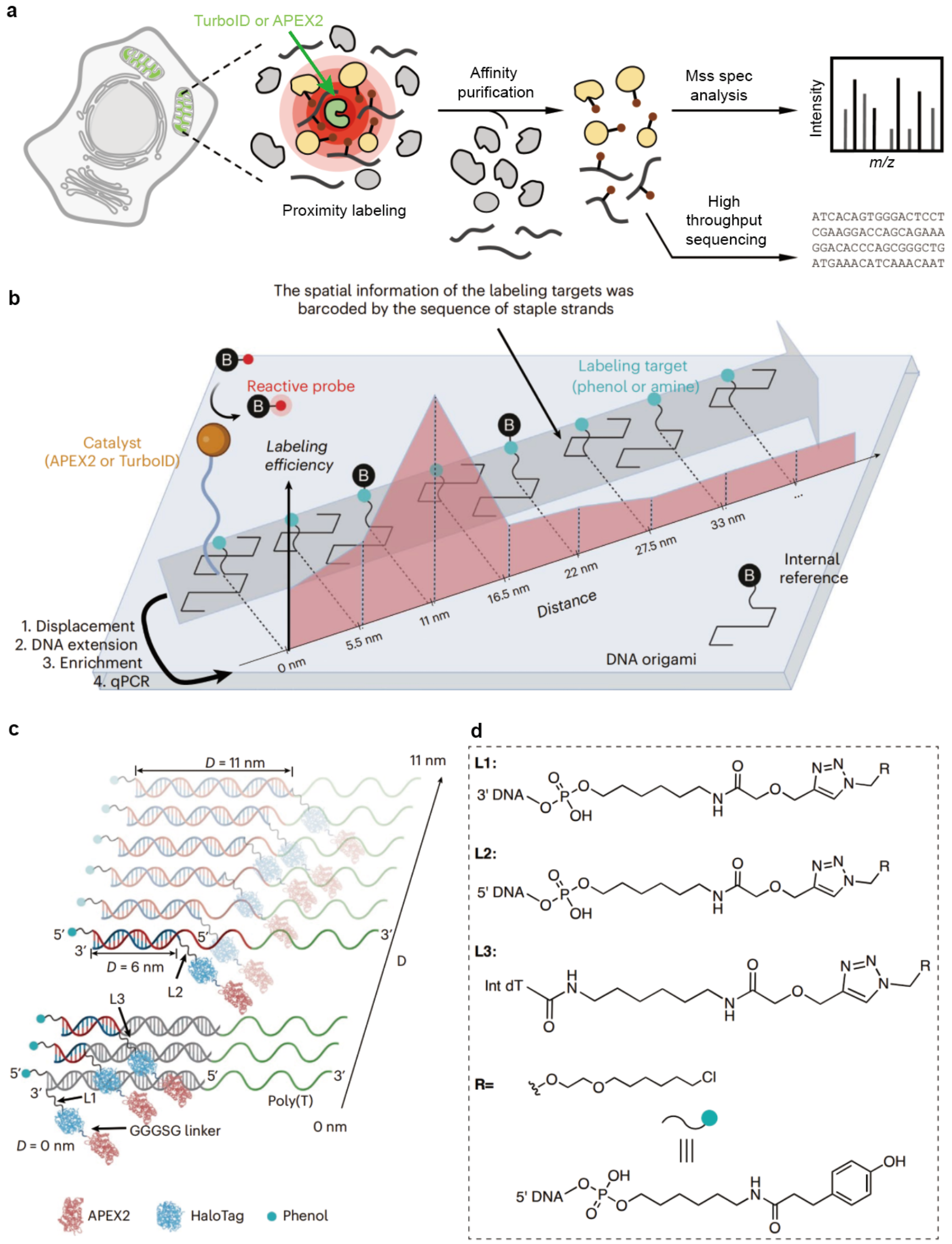
图1.构建空间纳米尺平台,测定邻近标记的作用半径。a. 邻近标记工作流程示意图3。图片修改自Zhou Y. et al.,2021。b.利用DNA折纸作为模板体外重构邻近标记系统。c.双链DNA(dsDNA)尺子可以以1纳米的步长控制酶和标记靶标的距离。d.连接子的化学结构。
该研究计划的提出起源于两个课题组间密切的交流合作。邹鹏课题组在实验过程中发现,TurboID往往比APEX2具有更高的标记空间分辨率,然而从化学性质上看,TurboID产生的腺苷化羧基应当比APEX2产生的酚氧自由基具有更长的寿命和更大的标记半径。这一反常结果引发了研究人员对两种邻近标记方法在标记半径及作用机制的浓厚兴趣。陈知行课题组长期致力于高性能成像探针的开发,并与邹鹏课题组保持着密切合作,双方此前已共同开发多款高性能膜电压探针(PNAS 2023, 120: e2306950120;Sci. Adv. 2025,11: eads1807等)。在讨论这一现象的过程中,陈知行课题组联想到DNA 折纸在超分辨成像中常用作“纳米尺”,鉴于其尺寸处于几十纳米量级,同时具备高度刚性与可编程性,因此非常适合作为测量邻近标记作用半径的理想工具。基于这一思路,团队利用DNA 纳米结构构建了可精确调控距离的纳米尺平台,以定量评估邻近标记的标记半径。通过在体外重建完整的邻近标记体系,对两类酶的催化特性和作用机制开展了系统而深入的研究。
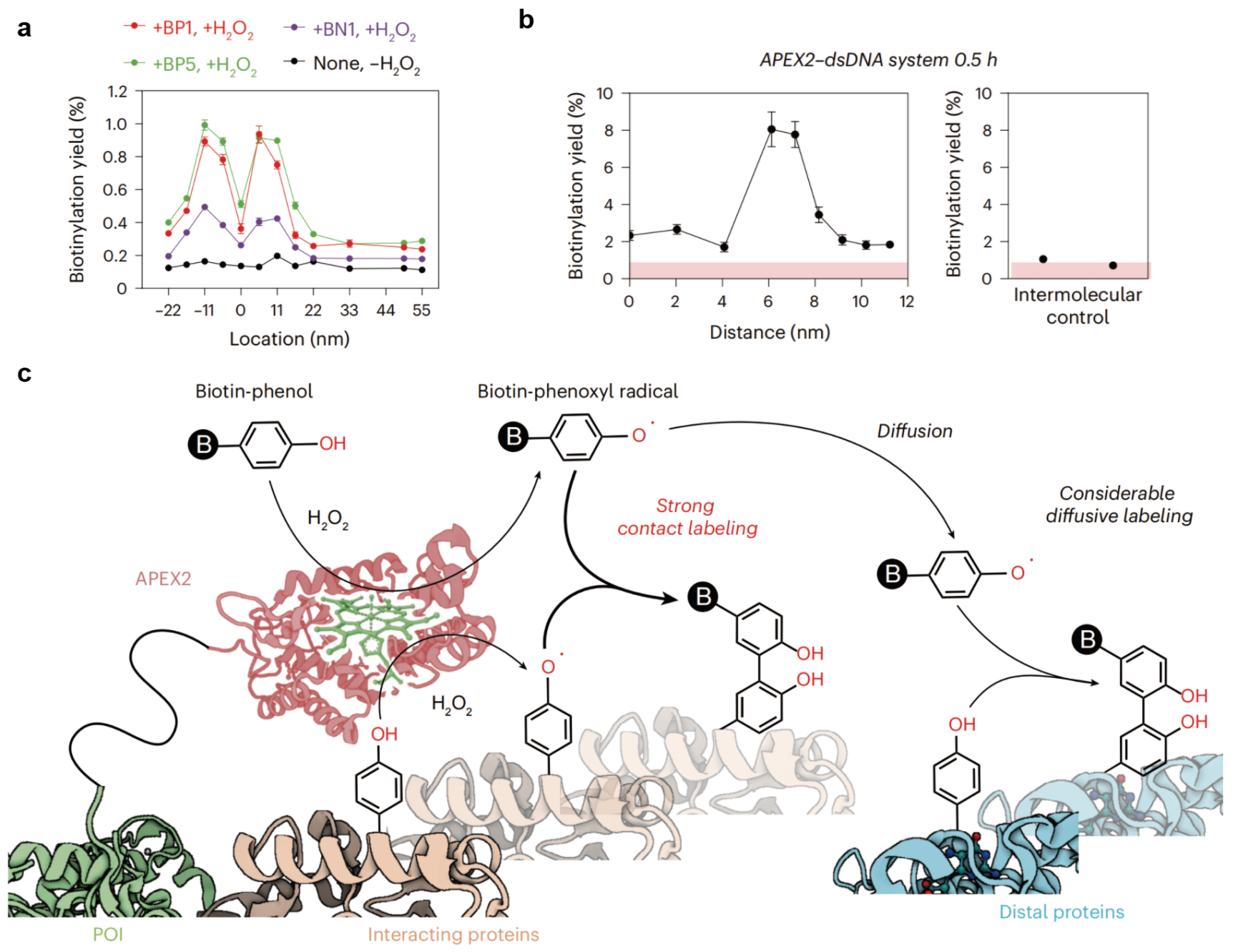
图2. 利用DNA纳米尺平台对APEX2的作用范围进行测量。a. APEX2-DNA折纸体系的测量结果。b. APEX2-dsDNA体系的测量结果。c. 该研究提出的APEX2的标记机制,同时表现出接触标记与扩散标记。
团队通过纳米尺平台测量了标记酶附近几十纳米内的标记效率,绘制了“标记效率-空间距离”曲线。对于APEX2标记,在DNA折纸体系中5-11纳米处(接触范围内)出现标记效率的峰值,意味着存在酶与底物的“接触标记”机制;在更远的距离(55纳米)仍可检测到显著高于背景的标记水平,与传统模型所描述的自由基“短程扩散”相符(图2)。在测量精度更高的dsDNA体系中,APEX2的标记表现出与DNA折纸体系同样的趋势。以上数据揭示了APEX2同时表现出接触标记与短程扩散两种反应机制。
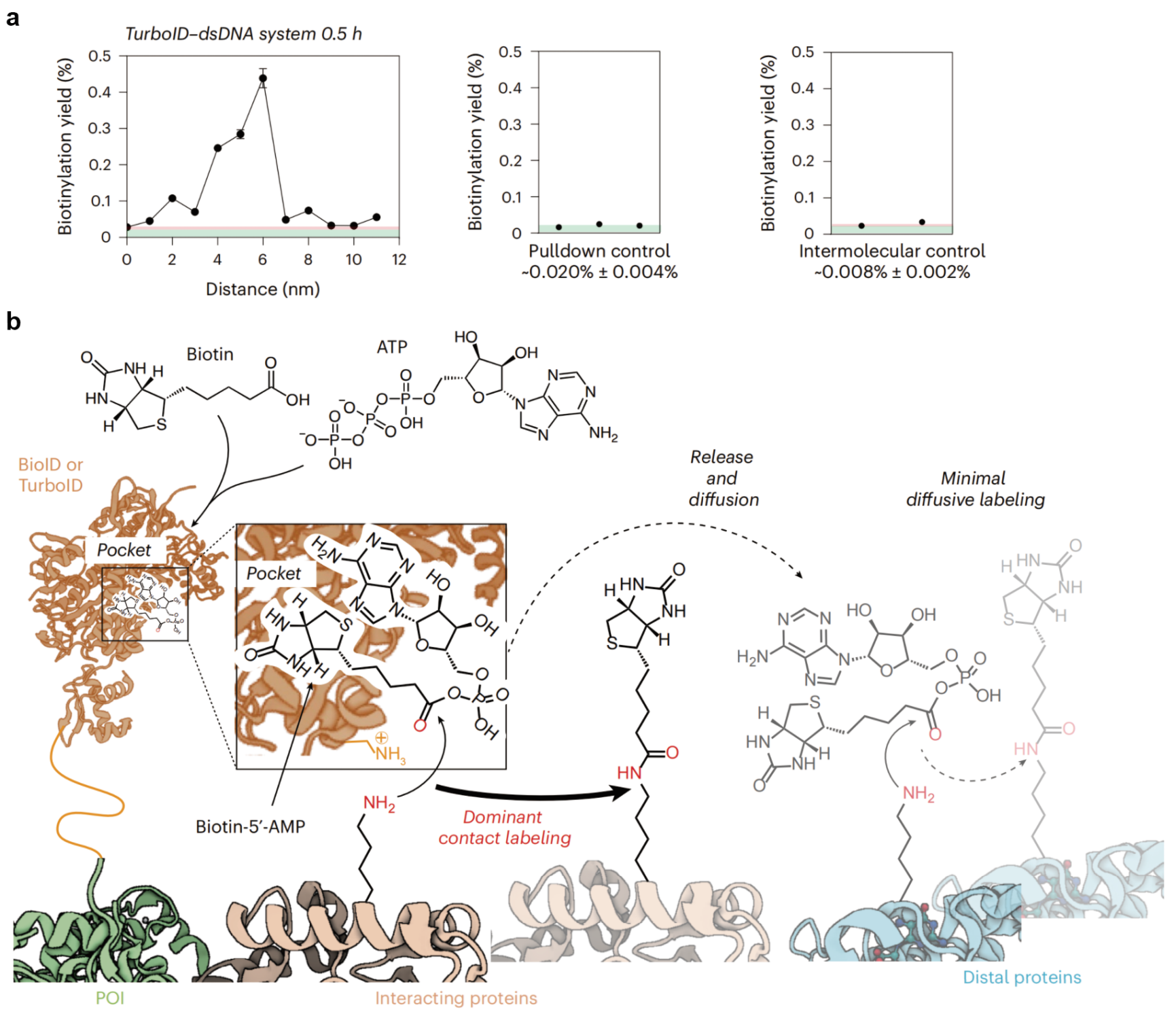
图3. 利用DNA纳米尺平台对TurboID的作用范围进行测量。a. TurboID-dsDNA体系的测量结果。b. 该研究提出的TurboID的标记机制,主要表现出接触标记。
团队进一步将该方法应用与测定TurboID的标记。通常人们认为TurboID的标记主要由活性中间体的扩散对周围的蛋白质进行标记。在接触范围内(0–6纳米),TurboID对近端的氨基产生高效标记;但随着距离增加至7纳米,标记效率迅速下降至接近背景水平。标记效率随距离的衰减过程呈现明显的急剧下降特征,不符合扩散控制模型的预期。从这些实验数据出发,团队提出,TurboID的标记主要由中间体在酶的口袋中与靶标分子的直接物理接触介导,而非由中间体在酶周围的自由扩散实现,因此TurboID的标记行为呈高度接触依赖性(图3)。这一观点进一步得到了生化实验的验证。
综上所述,该研究通过DNA纳米结构平台在体外重建邻近标记系统,实现了对邻近标记酶空间作用范围的首次直接量化,为理解标记机制提供了系统、可控的实验框架。该成果具有以下意义:
1.为邻近标记实验的解释提供机制的依据,研究人员在分析蛋白互作或空间邻近关系时,需要将“接触主导机制”纳入考虑,以避免对标记范围的过度推断。
2.该研究展现了DNA纳米尺在1–100 纳米窗口内分析微观生化反应的强大能力,与荧光共振能量转移(FRET)1–10 纳米的动态范围以及20纳米范围内进行精确测量的超分辨率成像相辅相成。
3.推动纳米尺度空间生化测量平台的发展,DNA纳米结构提供了一种可普适化的策略,用于研究活性中间体扩散、反应局限性及其他纳米级空间限域效应。
122cc太阳成集团未来技术学院陈知行研究员和太阳成集团tyc122ccvip邹鹏研究员为本论文的通讯作者,122cc太阳成集团未来技术学院2021级博士生杨哲为本论文的第一作者。张玉、方煜新、张源、杜佳晟、沈潇雯和张珂诚等也为本研究做出了重要贡献。本研究得到了国家自然科学基金、科学技术部、李革赵宁青年科学基金、北大-清华生命科学联合中心和北京国家分子科学实验室的资金支持。特别感谢斯坦福大学Alice Ting教授、美国西南医学中心Boyuan Wang教授对本工作的讨论和建议。
原文链接:https://doi.org/10.1038/s41589-025-02086-w
References:
1. Seath, CP., Trowbridge, AD., Muir, TW., MacMillan, DWC. Reactive intermediates for interactome mapping. Chem Soc Rev 50, 2911-2926 (2021).
2. Qin, W., Cho, K.F., Cavanagh, P.E. et al. Deciphering molecular interactions by proximity labeling. Nat Methods 18, 133-143 (2021).
3. Zhou, Y., Zou, P. The evolving capabilities of enzyme-mediated proximity labeling. Current Opinion in Chemical Biology 60, 30-38 (2021).
4. Lam, S., Martell, J., Kamer, K. et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods 12, 51-54 (2015).
5. Branon, T., Bosch, J., Sanchez, A. et al. Efficient proximity labeling in living cells and organisms with TurboID. Nat Biotechnol 36, 880-887 (2018).
审核:牛林,刘志博